中国粉体网讯 仿制药起源于美国。1984年美国约有150种常用药专利到期,大药商认为无利可图,不愿意继续开发。为此美国出台法案,新厂家只需向FDA证明自己的产品与原药生物活性相当即可仿制,仿制药概念由此出现,后被欧洲、日本等采用。
目前,中国药品批号约有16万个,其中90%以上都是仿制药。近期那部票房颇高、反响强烈的电影中涉及到的印度抗癌药就是一种仿制药。那么,仿制药是如何生产出来的呢?下面我们一起来了解一下。
一、原料药的属性研究
原料药的属性研究对制剂的开发至关重要,它不但会影响药品的质量,还可能会带来生物等效性风险。

这些属性会影响到药物的溶解度、稳定性,对后期药品的开发造成巨大的影响。其中:
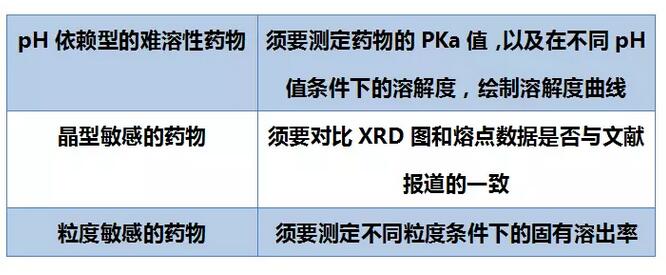
除此以外,晶癖、比表面积也要适当地关注。
二、原研药成分的反向研究
与原研药保持一致的处方成分,对产品开发的成功率有很大帮助。原研药的处方在哪里能找到呢?

药品成分包括:


辅料的定量检测具有挑战性,其困难主要来自于产品中其它辅料或API的干扰,所以一般在对某种辅料进行定量检测前,会尝试采用一些手段将其提取出来,如通过过滤方式分离或通过组分间溶解度的差异进行分离等。
除了辅料研究,活性成分API的研究一般包括:
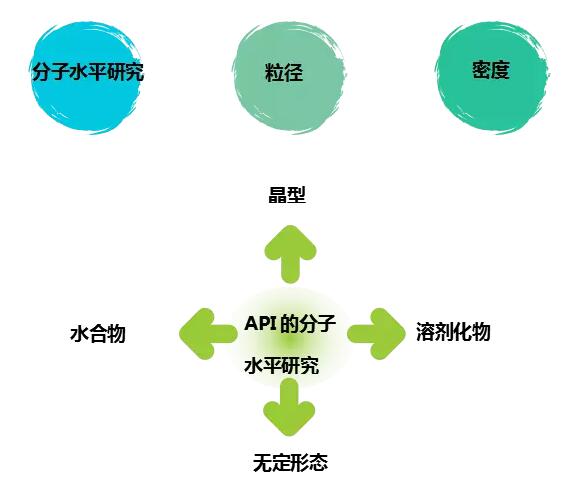
在仿制药的研发过程中,API的多晶型是研究得最多的,也是最重要的。
API的粒径是一个关键的研究点,尤其是对于难溶性药物。难溶性药物一般可采用粉碎法或微粉化法考察筛选出一个适合的粒径范围。但因制剂成品中的辅料干扰,常规检测粒径的技术不适合制剂成品,目前可行的方法可能只有显微镜法。
API的密度检测一般为退密度(BD,Bulk density)和振实密度(TD, Tapped density),根据这两组数据从而计算出Carr指数和Hausner指数,评估API的流动性。
三、仿制药的处方工艺开发
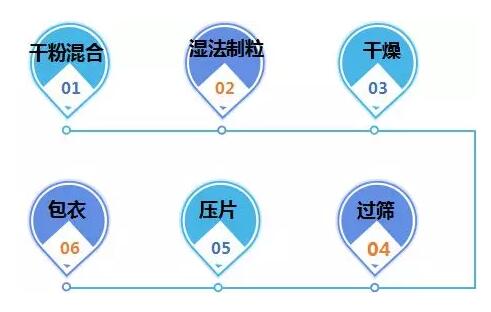
口服固体制剂(片剂、胶囊剂)一般采用的生产工艺有:

根据API的稳定性、API在成品中的占比、流动性和可压性等选择以上相适应的工艺。
同时,也可在EMA中查询原料药和制剂成品的工艺步骤,如在EMA中查询到的某原研药片的生产工艺步骤:
以下列表是湿法制粒工艺开发时各工艺步骤中需考虑的工艺因素和质量属性。

四、中试及批量化生产
在完成处方工艺的研究开发之后,可以逐步放大到中试和生产级别。按照新的法规,一般情况下中试批量要大于10万个制剂单位,对于剂量小的产品,可能要做到30-50万个制剂单位以达到大生产批量的十分之一,而且要获得连续三批的数据。因此对中试放大务必要谨慎,尽量在小试中发现问题并解决掉,做到防患于未然。
参考资料:
仿制药制剂开发流程
浅析仿制药一致性评价片剂湿法制粒工艺的开发
仿制药研发中的反向工程


















