中国粉体网讯 对于制剂人来说,新药不再是拿到一个化合物简单做成片子或者胶囊,简单做做处方前,简单研究以下处方工艺,简单搞一批小试,简单在GMP条件生产一批,简单写一份申报资料,就这样简单的完成了一个新药的IND申报。它需要制剂人重新审视新药研发对于新的制剂技术的需求,需要制剂人紧紧跟随上国内外新药研发的最前端。国内外CRO、CDMO作为新药研发的最前端,因为他们比一般的甲方公司接触到更多的化学实体,从其公司宣传的技术来看,无不在固体分散体这种技术上有所布局,可见市场对其需求之火热。正如文献资料所报道的那样,难溶性药物已经充斥着新药的研发产线,研发中的新药90%都是BCSⅡ和Ⅳ类,真实情况可能尤甚。诚然,有幸接触固体分散体开发的项目,也算打开了眼界,有机会去学习其知识,懂得其机理,掌握其技术,故而称之为机遇。
机遇和挑战就像是双生子一样,如影随形,固体分散体开发亦是如此。因为新药固体形式的选择一般为多晶型中的稳定晶型,即优势晶型,亚稳定晶型都不作为备选考虑,无定形更是不会入选,因为其太容易转变成亚稳定或者稳定型,对于这种不可控的情况,对于最终制剂产品的质量将造成毁灭性的影响。然而,固体分散体确实反其道而为之,恰恰采用了药物的无定形这种最不稳定的固态形式,以解难溶性药物的难溶之急。如何保证采用无定形形式药物保持无定形形式的稳定不转晶,保持其在胃肠道足够长的过饱和时间,这便是固体分散体开发最大的挑战,同时也是对于制剂人的挑战。需要学习其转晶之机理,知己知彼,掌握应对之法,终得解决之道。
众所周知,临床前制剂配方的选择策略是选用最简单的配方,提供所需要的最大暴露量以支持所需要的研究。溶液制剂制备简单,药物以溶解状态存在且易于给药,是最理想的选择。即使单溶剂药物溶解达不到要求,可以使用共溶剂系统,而且对于酸碱性药物可以根据其pKa,使用pH调节剂,帮助化合物的溶解。同时也可以使用环糊精,与单独的API相比,可以帮助客体分子溶解和溶出。
对于难溶性药物来说,简单的溶液剂可能不太合适,尤其对于高剂量化合物,API的溶解需要动用大量的赋形剂,小动物的耐受问题就需要格外的关注了。对于某些化合物,可以通过高压均质或者研磨的手段制备成混悬液或者纳米混悬液,提供化合物体内的暴露量,对于API溶解度过低,不见得好使(微粉,纳米晶体更多的是通过降低药物的粒径,增加药物表面积,以提高其与介质的接触,进而增加药物溶出速率。)。但然,也可以通过盐型的筛选,以提高化合物的溶解度和溶出,当时对于成盐的化合物需要关注其在胃肠道环境中溶解度的变化而造成的析晶现象,而且即使盐型筛选需要花费大量的时间和资源,且关注其溶解度,引湿性,稳定性的同时,也要关注其可生产与扩展性(盐型也具有多晶型,一旦选定某种盐型,也需要进行优势晶型的筛选)。也有人通过脂质制剂,如纳米乳,自微乳药物递送系统,递送难溶性药物。脂质制剂可以增加药物的分散性和润湿性,提供药物在胃肠道保持饱和状态,从而促进难溶性药物的体内吸收。但是其配方复杂,需要进行大量试验筛选赋形剂且其体内体外相关性较大。其实,对于难溶性药物,在早期临床前,选择开发成固体分散体制剂是具有极大的优势的。
首先固体分散体技术可以通过使药物分子以无定形形式分散在聚合物中,确实的提高了难溶性药物的溶解度和溶出,而且在临床上已经获得了证明,目前采用分体分散体技术上市的药物也三四十来个。其次,固体分散体采用的配方极其简单,一般为聚合物和API的二元混合物(也有添加表面活性剂的三元系统),且聚合物多采用HPMC,HPMCAS,PVP VA和PVP,这些聚合物多是天然衍生物,无毒,具有安全性,在很多申报的新药案例中也得到了验证,易于获得监管机构的批准;临床前实验中,赋形剂对于啮齿类动物的耐受性也是一个需要关注的问题,这些赋形剂的安全性,获得广泛研究,耐受性即使在人体也不会有问题。
与液体制剂相比,固体分散体更好的衔接临床前试验与临床试验。固体分散体在临床前试验中,进行了聚合物种类和载药量的筛选,进行了大量表征,确定其配方和工艺,制备得到产品质量稳定,满足体内暴露要求。一旦进入临床研究,无需变更处方,可以在后期临床研究中快速推进,对于一些获得快速审批的化合物更加有利于其获得申报上市;处方的一致性,避免了下游的风险,比如临床前试验采用液体制剂,对于难溶性药物可能加入增溶的物质,临床开发变成固体制剂,会影响体内暴露的差异,无法做到衔接,配方又需要投入物力和时间进行研究。
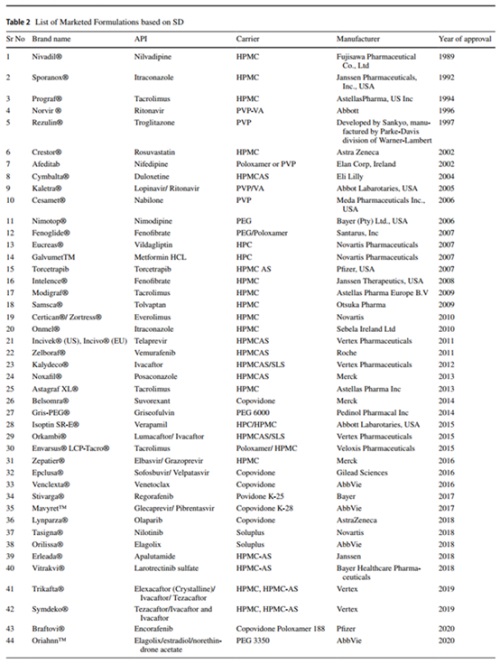
图1 已上市ASD制剂产品 (来源于参考文献1)
固体分散体制备工艺通常为喷雾干燥和热熔挤出。喷雾干燥适用于API和聚合物在合适的挥发性有机溶剂中具有高溶解性。热熔挤出适用于API具有合适的热稳定性,并且能够在药物聚合物加工温度下具有良好的相容性。这两种制备工艺都可以连续生产且易于放大,随着批量的变化有合适的设备进行匹配。
从研发上看,固体分散体Los to the clinic,避免了配方变更带来的体内暴露的问题,且配方简单,无毒安全,易于选择合适工艺进行生产方法。但是,固体分散体的开发所面临的挑战也是无处不在的。
首先在临床前试验早期,API的可及性问题限制研发的向前推进。在药物研发早期API的制备批量通常较小,以节省时间和资源。一旦API显示良好的有效性和安全性,批量才会增加。那么,如何平衡API量少和固体分散体开发便是一个重大的挑战。固体分散体开发的关键在于聚合物种类和载药量的筛选。
API和各种聚合物的溶解度参数的比较通常用于选择用于分散研究的聚合物。有人建议,如果溶解度参数的差异小于7mPa0.5,组分将是可混溶的,如果溶解度参数的差异大于10mPa0.5,则两者将不可混溶。计算API的溶解度参数并找到具有相似值的聚合物是缩小筛选中聚合物的一种方法。这不应是用于选择聚合物的唯一标准,因为可能存在其他特性,例如离子相互作用,可能会忽略溶解度问题。然而,它可用作确定聚合物列表的初始起点。还有一些计算机筛选的方法,模拟API与聚合物之间的作用力,但是此种方法过度简化了此种相互作用且聚合物的分子量给计算机模拟带来了挑战。
载药量是固体分散体开发的不可忽视的拦路虎。一般情况下,聚合物使用的量越大,API在聚合物中分散的越大,无定形分子相互汇聚的风险越小,无定形固体分散体越稳定,特别对于API无定形化比较困难的API。但是一般固体分散体的载药量为10-30%之间,主要为了平衡固体分散体的稳定性和后续制剂开发的可行性。聚合物使用太少,固体分散体不稳定,聚合物使用过多,临床前动物试验制剂无法配制且后期制剂开发中片剂或者胶囊重量较大,病人的顺应性下降。
最后,固体分散体开发还有一个挑战,就是API的理化性质极度不友好,比如熔点较高。一般化合物溶解度限制步骤在于晶格能较高,表现为熔点较高,一般大于200℃,不太利于热熔挤出工艺。对于某些化合物在有机溶剂里面,溶解度依旧不佳,即使想通过喷雾干燥制备固体分散体也需要动用大量的溶剂,这样就给操作的安全性和环境的友好性带来了挑战。
总而言之,固体分散体的开发是机遇与挑战同在的,既要看到其对于我们个人所带来的积极一面,同时也需要我们付出努力与心血;既要看到固体分散体在实际研发中所具有的优势,同时也要努力去解决研发过程中的困难。随着新药化合物分子溶解性比较差的情况越来越严重,这样的药物将会影响药物的体内吸收和生物利用度,限制药效的发挥。在药物固态筛选之时不再是仅仅考虑筛选优势晶型,还应该考虑无定形固体分散体在提高药物溶解度中的巨大作用。选择简单片剂或者胶囊处方,或许不再是那么容易。
参考文献:
1.Solid dispersion technology as a formulation strategy for the fabrication of modified release dosage forms: A comprehensive review.
2. Amorphous solid dispersions: Utilization and challenges in preclinical drug
development within AstraZeneca.
(中国粉体网编辑整理/青黎)
注:图片非商业用途,存在侵权告知删除


















