中国粉体网讯 药品是一种特殊的商品,质量的稳定与否有时直接关系到人的生命。随着药品生产技术的不断进步,药品质量管理方法也不断创新,从卫生部颁布药品 GMP 首次将其纳入法规范畴至今,我国共有 4 个正式版本的药品 GMP,分别是由卫生部颁布的《药品生产质量管理规范》(1988 年版)和 1992 版药品 GMP,由国家药品监督管理局颁布的 1998 版药品 GMP 以及卫生部最新颁布的新版药品 GMP。
药品GMP
药品生产质量管理规范,英文即 Good Manufacturing Practice for Drugs,简称为药品GMP。2010 年,我国推行了新版 《药品生产质量管理规范》,对原有的规范进行了全新的修订,并强制要求境内的所有药品生产企业从 2011 年 3 月起必须严格按照新版 GMP。
GMP,直译为 “良好的操作规范”,或是 “优良制造标准”,是一种特别注重制造过程中产品质量与卫生安全的自主性管理制度它是一套适用于制药行业的强制性标准。药品 GMP 的三大目标要素是:将人为的差错控制到最低限度;防止对药品的污染和降低质量;建立保证高质量产品的质量体系。具有原则性、时效性、层次性、基础性、多样性等特点。
目前,GMP 在世界范围内已经被多数国家的政府、制药企业和医药专家认为是制药企业和医院制剂室进行质量管理的优良的、必备的制度,是世界各国对药品生产全过程监督管理普遍采用的法定技术规范。
GMP时代,如何运用激光粒度分析软件应对规范要求
激光粒度仪以激光作为探测光源,具有测量范围宽、测量速度快、非接触在线测量、重复性好等一系列优点,已经在粉体、医药、电池等领域得到广泛的应用。
激光粒度仪工作原理
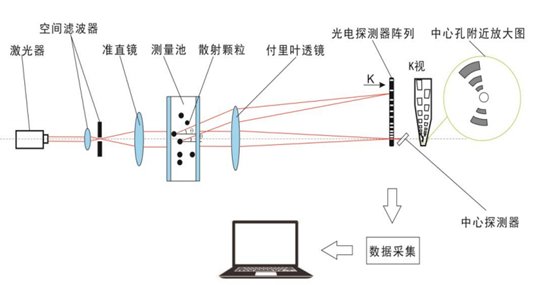
来源:珠海真理光学仪器有限公司
激光粒度仪在药物生产和研发中的应用已经相当普及,而激光粒度仪的测试数据都是由计算机处理和储存的。
2015年5月26日,CFDA正式发布了2010版GMP法规的新附录之一《计算机化系统》,于2015年12月1日起执行。
❖ 《计算机化系统》的核心内容如下:
——计算机化系统验证的要求
—— 数据合规性要求,包括
(A)访问控制
(B)权限设置
(C)数据完整性
(D)审计追踪(可调整项)
(E)电子签名(非强制项)
——电子数据安全性要求
——数据备份要求
GMP时代,如何运用激光粒度分析软件应对规范要求?2019年3月12-13日,中国粉体网将于泉城济南举办“2019全国医药粉体制备及物性表征技术高峰论坛”,届时张福根博士将作《激光粒度分析软件对GMP规范的解决方案》报告,敬请关注。
张福根博士简介
于1989年从天津大学取得博士学位,主攻光学仪器专业。1993年和朋友联合创办欧美克公司,利用自己所学,研究开发以激光粒度分析仪为主的颗粒测量仪器;2011年,受聘天津大学兼职教授,指导博士和硕士研究生开展光散射理论基础研究;2015年,加入珠海真理光学仪器有限公司,再次投身颗粒测试产品的商业化工作。