中国粉体网讯 元素杂质又称重金属,重金属原义指比重大于5的金属,元素杂质包括可能存在于原料、辅料或制剂中,来源于合成中催化剂残留、药品生产制备过程中引入或辅料中存在的、生产设备引入、或容器密闭系统引入。某些元素杂质不仅对药品的稳定性、保质期产生不利影响,还可能因为潜在的毒性引发药物副反应。
因此欧盟、美国对杂质的控制越来越严格,对此项不断修订,中国在加入ICH后对此项检测应该也会向国际靠拢,因此了解法规对元素杂质的要求、建立有效的检测方法变得尤为重要。
一、各国法规变更史
(1)EMA、EP关于元素杂质的修订
EP最新版为9.0版,其中保留了2.4.8金属测试方法A-H;2.4.20章节金属催化剂和金属试剂残留检测;5.20金属催化剂或金属试剂残留。但在9.3增补版(2018年1月1日实施)中5.20项下规定,元素杂质限度遵循ICH要求。EMA对元素杂质的修订如下表1。

(2)ICH对元素杂质的修订历程
ICH于2009年10月批准了Q3D,经多方讨论后,修订版本的Q3D step4于2014年12月16日生效,其中列出了24种元素杂质的三种给药途径的PDE值,确定实施日期为:新上市许可为2016年6月生效,已上市品种为2017年12月生效。
(3)USP对元素杂质的修订历程
FDA规定在2018年1月1日之后,针对USP药典品种,提交新的NDA、ANDA应该符合USP<232>、<233>。针对非USP药典品种,申请人提交新的NDA、ANDA时,应该遵循Q3D。美国对元素杂质的规定与ICH规定在不同时期,内容不一致,但从2017年12月之后,USP对元素种类和限量均与ICH保持一致。修订历程详见下表2。

(4)中国药典对重金属检测的修订
中国药典对重金属检测的修订主要体现在表3中,名称仍然为重金属,方法仍采用比色法,2017年中国成为了ICH成员国,未来中国的药政监管将遵循ICH指南规定,元素杂质与国际接轨也是大势所趋。

二、ICH对元素杂质的分类及限度
(1)元素杂质分类
第1类:元素砷(As)、镉(Cd)、汞(Hg)和铅(Pb)是对人有毒性的物质,药品生产中不得使用或限制使用,通常来源于矿物赋形剂。因此,所有给药途径的风险评估中都必须评价这4种元素。
第2类:本类别中的元素一般被认为是与药物的给药途径有关的物质,又分2A、2B两类。
2A类:元素钴(Co)、镍(Ni)、钒(V)。在药品中出现可能性相对较高的元素,因而需要对所有元素杂质的潜在来源及所有摄入途径(如所指)进行风险评估。
2B类:元素银(Ag)、金(Au)、铱(Ir)、锇(Os)、鈀(Pd)、铂 (Pt)、銠(Rh)、钌(Ru)、硒(Se)、铊(Tl),这些元素在自然界中稀少,在药品中出现的可能性较低。除非其在原料药、辅料或药品的其它成分生产中被有意加入,否则可被排除在风险评估以外。
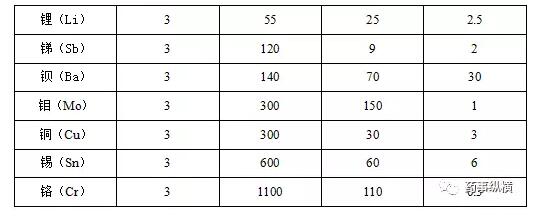
第3类:这类元素包括钡(Ba)、铬(Cr)、铜(Cu)、锂(Li)、钼(Mo)、锑(Sb)、锡(Sn)。这类元素在口服摄入时具有相对低的毒性,但在吸入和注射给药的风险评估中需要进行考虑。口服给药,除非在原料药、赋形剂或药品的其他组分生产中有意添加,否则不需要在风险评估中进行考虑。注射和吸入给药,除非给药途径的PDE超过500ug/day,否则在风险评估中要评价这些元素出现的可能性。
其他元素:这些元素杂质毒性较低和/或在地方法规中的要求不同,没有规定PDE,在该指南中并未说明。如果这些元素出现或包括在药品中,按照其他指南或区域法规进行处理。该类元素包括铝(Al)、硼(B)、钙(Ca)、铁(Fe)、钾(K)、镁(Mg)、锰(Mn)、钠(Na)、钨(W)、锌(Zn)。如: 铝,损害肾功能,锰和锌对肝功能不全的病人有害等。
(2)24种元素杂质的限度
对日剂量不超过10g/天的药品中含有的元素杂质允许浓度限度(见表4),方法1假设制剂中所有组分都满足元素限度,每日药物摄取量不超过10g,使用公式1,计算出药品每种成分的允许目标浓度。公式1:
浓度(μg/g)=PDE(μg/d)/药物日用量(g/d)
若表4中允许浓度不适用,则使用方法2a或2b进行计算,本文不进行赘述,详细参考ICH Q3D的计算方法。

三、元素杂质的一般控制策略
根据元素杂质的来源来进行控制,一般元素杂质来源有:1、原料药、辅料、或制剂其他组分生产过程中有意添加的,如金属催化剂;2、制药用水或辅料、原料等;3、原料药或制剂生产设备引入;4、原料药或制剂容器密闭系统引入的,一般固体制剂密闭系统浸出可能性小,液体或半固体制剂,在储存过程中引入元素杂质的可能性较高。
对于生产过程中有意或无意添加的,可通过改进工艺步骤,使用特定或非特定的精制步骤将元素杂质减低至控制阈值以下;选择生产设备、设备验证及GMP规范来降低;制药用水则需严格遵守各药典对制药用水的质量要求来降低;或实施中控或者上游控制,控制元素杂质浓度,建立辅料或原料药中间体的质量标准限度,建立原料药质量标准限度。针对密闭系统引入的应当选择适当的容器包装系统。
四、元素杂质的检测方法的比较
(1)比色法
比色法为先有中国药典采用方法,主要是重金属与硫代乙酰胺反应产生硫化物沉淀,将沉淀物反应显色与10ppm的标准铅进行目视对比,定性分析重金属是否超标,这一方法测试结果不准确、缺乏专属性、灵敏度,而且结果显示是重金属的总量值,不能很好显示具有遗传毒的金属元素杂质的残留量。
(2)ICP-MS法
EP专论中2.4.20提及方法,这一方法检出限低,可至ppt级别残留物,线性范围宽,光谱也比较简单,适用于同位素分析。但其光谱干扰严重,耐盐性差,在盐条件下,检出优点差50倍,轻元素(如Ca、K等)会产生严重干扰,恶化其检出限。更重要的是,这一方法检测成本高,仪器维护频繁。
(3)ICP-AES
EP专论中2.4.20提及方法,这一方法的检出限高于ICP-MS,可达到1-10ppb级别,精密度跟准确度高,线性范围也较宽,可以同时测定多种元素。但其获得的谱线复杂,由于严重的光谱干扰,分析测试能力降低。仪器维护成本相对ICP-MS低,但相对原子分光光度法高。
(4)原子吸收分光光度法(FAAS GFAAS)
FAAS常用于Na、K、Ca、Mg、Fe、Zn、Li等元素的分析,检测限度为ppm级,相对于以上两种,费用便宜,操作简单,重现性较好。但其一次检测只能检测一种元素,需要配备多个灯,基体的干扰比较严重,线性范围也较窄,分析速度也没有前述两种快。
GFAAS比较适用于Pb、Au、Al等检测,分析所需样品量少,适用于贵重物品分析,检测灵敏度较FAAS高,仪器不贵,操作简单,重现性较好。但其耗材偏贵,开发方法费时。
五、案例分析
某口服给药制剂,原料药合成工艺中使用钯金属催化剂,且在第二步使用到此催化剂,根据ICH规定,钯属于2B类金属,根据之前EMA的对金属催化剂残留的相关规定及其解释:在合成最终步骤之前形成或引入一类重金属,在合成中间体中通过适当的限度进行控制,且检验结果已清楚证明该金属存在的水平不超过限度指南的30%,可以考虑在成品的质量标准中不包括该金属。
参考这一解释规定,对于合成反应中第二步引入的2B类重金属催化剂残留,理应考虑在第二步产生的中间体中进行控制,但考虑到第三步的反应夹带及第五步的反应精制步骤,钯的残留会小很多,同时考虑到钯的限度仅10ppm,在第二部产生中间体中进行控制,很容易超标。故选择在第五步反应产生中间体中检测此重金属残留情况,采用ICP-MS法进行检测。经过检测,其结果小于限度的30%,日常检测可以采用跳检的方式进行控制。
另外,对于一类金属、2A类金属,若在生产过程中设备、制药用水有可能会夹带引入,需要对其进行不存在验证,检测中试6批或商业3批,若均检测不到或远低于限度规定,则无需定入质量标准,若检测到,且低于限度30%,则根据需要酌情处理。
综上所述,针对不同情况,可以选用不同仪器、方法进行检测,以达到即可满足检测限要求,又可省时、省力、省钱。总体来说,比色法在未来可能会被其他几种方法替代。另外对于元素杂质的风险控制而言,需要各部门配合,制定合适、合理的检测方法、限度,做到既不浪费人力、物力,又可准确把控风险。
参考文献
(1)ICH.ICH Q3D Guideline for Elemental Impurities
(2)European Pharmacopoeia Commission.European Pharmacopoeia 9.0
(3)Ball D,Blanchard J,Jacobson-Kram D, et a1.Development of Safety Qualification Thresholds and Their Use in 0rally Inhaled and Nasal Drug Product Evaluation[J].ToxicoI Sci,2007,97(2):226-236
(4) U.S. Pharmacopeia Convention -USP40
(5)European Pharmacopoeia Comments concerning revised texts published in Supplement 9.3
(6)IPCS.Environmental Health Criteria 240 Principles and Methods for the Risk Assessment of Chemicals in Food。Chapter 5:Dose Response Assessment and Derivation of Health Based Guidance Values(s).Geneva World Health organization,2009.
(7)www.ema.europa.eu
(中国粉体网编辑整理/平安)