中国粉体网讯 在过去的35年中,吸入制剂制造商采取了各种策略,在原研吸入制剂上设立监管独占权和专利权,以限制仿制药的竞争。
重视专利和监管独占权
吸入制剂是治疗哮喘和慢性阻塞性肺病的主要药物。这些产品在美国面临的仿制药竞争不充分,而且价格依然昂贵。为了更好地了解原研吸入制剂制造商为维护其市场主导地位而采取的策略,我们分析了1986年至2020年间美国食品药品监督管理局批准的所有吸入制剂专利和监管独占权。在获批的62种吸入制剂中,有53种是原研产品,这些原研产品在仿制药竞争中的保护期中位数为16年。只有1种吸入制剂含有新作用机制的成分。一半以上的专利涉及吸入装置本身,而不是这些药物与装置组合的活性成分或其他方面。制造商通过将活性成分从一种吸入装置转移到另一种吸入装置("装置跳转"),进一步延长了原研市场独占期。从原研产品获批到原研后续产品专利或监管独占权期最后到期的时间中位数为28年(14种原研产品的器械循环)。监管改革对于确保原研吸入制剂制造商的专利权能更好地反映新产品的临床效益至关重要。
吸入制剂是治疗哮喘和慢性阻塞性肺部疾病(COPD)的主要药物。尽管已上市数十年,但这些产品的价格仍然很昂贵,目前约占美国处方药零售总额的5%。高昂的吸入制剂价格导致自费支出增加,这可能会导致用药依从性差以及哮喘和慢性阻塞性肺病加重更频繁。解决这一问题的关键是了解阻碍仿制药吸入制剂竞争的障碍。吸入制剂与胰岛素笔、尼古丁贴片和其他的药物-器械组合一样,都含有药物,这些药物与给药所需的器械一起出售。由于生产药物-器械组合的复杂性,FDA 在批准可互换的仿制药吸入制剂时采用了一套特殊的监管要求(一种综合的 "证据权重 "方法)。仿制药制造商必须进行体外、体内、药效学或临床终点研究,以及 "人为因素 "研究,证明患者可以像使用原研吸入制剂一样无差错地使用仿制吸入制剂。在满足这些旨在确保可互换仿制药-器械组合质量的监管要求时,仿制药制造商必须避免侵犯原研产品的专利权。当原研制造商向 FDA 申请产品专利时,FDA 将被禁止批准该产品的仿制药,直到专利到期或受到质疑并被推翻。
专利保护及其与监管体系的联系为原研吸入制剂制造商通过某些 "生命周期管理 "策略限制仿制药竞争创造了条件。他们还可以在获得专利的同时获得 FDA 授予的法定监管独占权,在吸入制剂获得批准后增加新的专利和监管独占权,将旧的成分合并到新的产品中,并将活性成分从一种吸入装置转移到另一种吸入装置。
美国食品及药物管理局在2000年代中期禁止使用含有消耗臭氧层的氯氟烷烃 (CFC) 的吸入制剂,这在保护环境的同时,也为制造商寻求新策略以维护其独占权创造了机会。如果监管者和政策制定者要实现促进仿制药吸入制剂竞争的目标(美国食品及药物监督管理局已将这一目标确定为主要优先事项),那么了解原研吸入制剂的制造商所采用的各种生命周期管理策略至关重要。
我们建立了一个新颖的数据库,收录了 1986-2020 年间美国食品及药物管理局批准的吸入制剂的所有专利和监管独占权,并分析了原研制造商如何将这些专利与监管独占权结合使用,以限制仿制药的竞争。
方法
队列识别
我们使用每年的 FDA 批准药物产品治疗等效性评价(桔皮书)和 Drugs@FDA中的产品标签来确定 1986-2020 年间批准的治疗哮喘和慢性阻塞性肺病的吸入制剂产品。我们从 1986 年批准的产品入手,因为从那一年开始,《桔皮书》每年都有连续的版本。这意味着排除了当时已经上市的吸入制剂,如早期的沙丁胺醇产品(这些吸入制剂的完整清单见附录附图 A1)。
数据提取
我们从 Drugs@FDA 获得了所有吸入制剂的 FDA 批准日期。对于批准后的每一年,我们使用当年的桔皮书提取吸入制剂的所有记录专利和监管独占权,以及这些专利和独占权的到期日期。监管独占权由 FDA 根据法定要求颁发,而专利权则由美国专利商标局 (USPTO) 授予,但两者的作用都是阻止 FDA 批准仿制药竞争者。为简便起见,"监管独占权 "和 "专营权 "这两个术语可以互换使用。
我们使用 LexisNexis TotalPatent One 提取了每项专利的标题、摘要、权利要求、美国申请日期和美国公布日期。我们使用 Google Patents 提取优先权日期,即特定专利族中任何成员的最早申请日期,包括在美国以外申请的专利。这些优先权日期是美国20年专利期限的起点(根据药品专利的特殊规定,专利期限可以延长)。我们查阅了每项专利的标题和摘要,必要时还查阅了全文,以确定专利是针对给药装置申请的,还是针对产品的其他方面(如活性成分、辅料或使用方法)申请的。我们将监管独占权分为FDA批准时授予的独占权(批准独占权)和FDA批准后授予的独占权(批准后独占权),并将专利分为 FDA 批准前申请的专利(批准前专利)和 FDA 批准后申请的专利(批准后专利)。专利申请日期是根据已成为授权专利的美国申请确定的。为了进一步确定批准后专利的性质,我们还分析了批准后专利的优先权日期是在 FDA 批准之前还是之后。
保护免受直接竞争的期限
我们通过将某一产品的FDA批准日期减去桔皮书中所列该产品最后到期的专营权或专利的到期日,计算出该产品免受直接竞争的保护期限。我们对批准时的保护(最后到期的批准独占权或批准前专利到期日与批准日之间的差额)和批准后获得的额外保护(最后到期的批准后独占权或专利与最后到期的批准独占权或批准前专利之间的差额)进行了区分。授权的仿制药药是由原研制造商销售或授权的原研产品,在本分析中不被视为直接竞争者。
统计分析
所有分析均在 STATA 16.1 (College Station, TX) 和 Excel 16.16.27 (Microsoft) 中完成。由于本研究不涉及人类受试者,因此无需获得机构审查委员会的批准。
局限性
对于近期批准的产品,我们可能低估了批准前专利的数量(以及批准前专利保护的持续时间),因为临近 FDA 批准时提交的专利可能仍在审查中或尚未列入桔皮书。同样,由于近期批准的吸入制剂制造商几乎没有时间增加批准后专利或监管独占权,我们可能低估了这些新增专利和批准后保护的持续时间。为了解决这一局限性,我们分析了制造商在 FDA 批准后增加专利和专营权的速度,而不仅仅是增加专利和专营权的绝对数量。尽管如此,我们的分析还是对制造商在 FDA 批准后增加专利和独占权的频率做出了保守的估计。最后,并非所有专利和独占权都能阻止仿制药竞争者进入市场。为了避免夸大专利和独占权在阻止仿制药竞争中的作用,我们还分析了当原研竞争者仍拥有有效专利或独占权时,仿制药竞争者进入市场的频率。
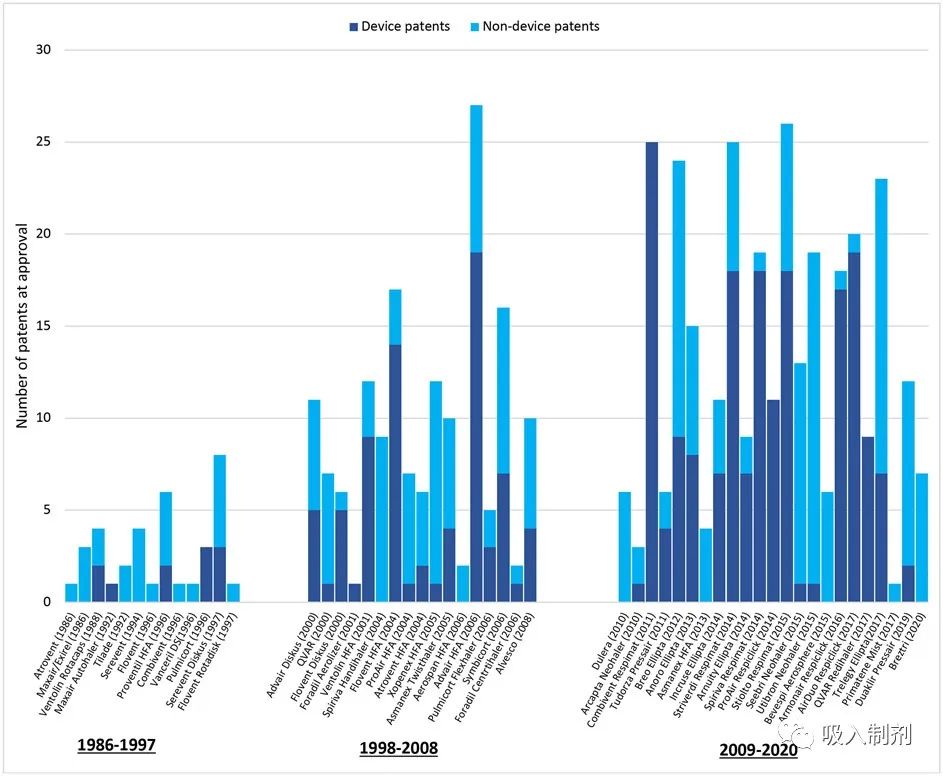
Exhibit 2: Patents per inhaler at FDA approval, 1986-2020
Source: FDA Orange Book, Drugs@FDA, authors’ analysis
This figure includes patents granted to inhalers that were filed prior to FDA approval. The median number of pre-approval patents grew from 2 per inhaler (interquartile range [IQR] 1-5) from 1986-1997 to 9 per inhaler (IQR 6-12) from 1998-2008 and 12 per inhaler (IQR 6.5-19.5) from 2009-2020.
结果
1986年至2020年间,FDA批准了62 种用于治疗哮喘和慢性阻塞性肺病的吸入制剂(附录 A2)。其中53种(85%)为原研产品,9 种(15%)为仿制药产品,包括7种仿制药沙丁胺醇吸入制剂和2种仿制药氟替卡松-沙美特罗吸入制剂。这些吸入药物有4种不同的作用机制:毒蕈碱类拮抗剂、ß2-受体激动剂、皮质类固醇抗炎药和肥大细胞稳定剂。在研究期间之前,这4种作用机制的药物均已在美国市场上市,并作为ß2-受体激动剂、皮质类固醇和肥大细胞稳定剂的吸入制剂供应(附录 A1)。在研究期间进入美国市场的唯一一种具有新作用机制的吸入制剂是 1986 年批准上市的异丙托溴铵(Atrovent)。
长效吸入制剂和含有 2 种或 2 种以上活性成分的复方产品,共有 10 种治疗类药物:吸入性皮质类固醇(ICS)、长效毒蕈碱拮抗剂(LAMA)、长效β-受体激动剂(LABA)、ICS-LABAs、LAMA-LABAs、ICS-LAMA-LABAs、短效毒蕈碱拮抗剂(SAMA)、短效β-受体激动剂(SABAs)、SAMA-SABAs 和肥大细胞稳定剂。这 10 个治疗类别中的 62 种吸入制剂含有 20 种不同的活性成分(见图 1)。
FDA审批时的监管独占权和专利权
17种原研吸入制剂(32%)在作为新化学实体获得批准时获得了监管独占权。这些独占权适用于该组 20 种活性成分中的 13 种(一些制造商获得了不止一种吸入制剂所含成分的独占权)。在批准时未获得新化学实体独占权的36种原研吸入制剂(68%)中,30种(57%)获得了其他独占权(包括新组合、新产品和新剂型的独占权),6 种(11%)在批准时未获得任何独占权。
制造商列出了每种吸入制剂 7 项批准前专利的中位数(四分位数间距 IQR 3-13)。器械专利占这些专利的 55%(268/490)。在研究期间,每种药物的批准前专利中位数从第一个十年(1986-1997 年)的 2 项(IQR 1-4)增加到第二个十年(1998-2008 年)的 8 项(IQR 6-11),再到最后十年(2009-2020 年)的 11 项(IQR 6.5-19)(见图 2)。每种药物的器械专利中位数从第一个十年的 0(IQR 0-2)增加到第二个十年的 3(IQR 1-5),再到最后十年的 7(IQR 1-14)。Advair HFA(氟替卡松-沙美特罗)的批准前专利数最多,为 27 项(包括 19 项器械专利),其次是 Stiolto Respimat(噻托溴铵-奥达特罗)26 项(18项器械专利)、Striverdi Respimat(奥达特罗)25 项(18 项器械专利)和 Combivent Respimat(异丙托溴铵-沙丁胺醇)25 项(25 项器械专利)。
批准时的保护期中位数为 15.4 年(IQR 11.5-17.4)。吸入制剂的批准前专利数量与这些专利所提供的批准前保护总期限之间存在微弱的相关性(R2=0.25)(附录A3)。
FDA批准后的监管独占权和专利
在获得 FDA 批准后,制造商又获得了 68 项法定独占权(附录 A4)。这些独占权是在吸入制剂获得批准后以平均每 8.2 年每种吸入制剂增加一项的速度增加的。
在研究期间,制造商还获得了 90 项批准后专利,即吸入制剂获得批准后每6.2年获得一项专利。77% 的批准后专利(69/90)的优先权日期在 FDA 批准之前,而 23% 的专利(21/90)的优先权日期在 FDA 批准之后。装置专利占批准后专利的 73%(66/90)。在至少获得一项批准后专利的 25 种吸入制剂中,有 11 种吸入制剂的批准后专利延长了专利保护期;这 11 种吸入制剂的专利保护期延长中位数为 7.1 年(IQR 1.8-8.2 年)。
免于竞争保护的总期限
总体而言,制造商从监管独占权和专利中获得的保护期中位数为16.0年(IQR 11.8-19.6)。最后到期的专利中有 53% 是器械专利(28/53)。SABA类吸入制剂在 FDA 批准后获得的中位保护期最长,为19.6年(IQR 10.0-21.4),其次是 SAMA-SABA 类18.8 年(IQR 18.7-18.9)和 ICS-LABA 类18.5 年(IQR 16.4-20.1)。
在研究样本中的53种原研产品中,只有1种在其独占权和专利到期前面临可互换的仿制药竞争:Teva 的 ProAir HFA(沙丁胺醇)拥有 27 年的专利保护期,但在2020年提前11年结束,尽管专利列在桔皮书中,但仿制药竞争者还是获得了FDA的批准。在这一案例中,仿制药制造商 Perrigo于2012年与Tevain达成和解,将进入市场的时间推迟到 2016 年,而FDA拒绝了 Perrigo最初的审批申请,导致了进一步的推迟。减去因仿制药提前进入市场而使Teva损失的 11 年时间后,同组中原研吸入制剂的市场独占期中位数为 15.4 年(IQR 11.7-19.2年)。
再生专利
专利经常涉及一种以上的产品。吸入制剂相关专利被列入桔皮书的中位数为2次(IQR 1-3)。在35个案例中,制造商在 4 种或更多产品上列出了相同的专利。其中26例(74%)涉及器械专利,包括勃林格公司的 Respimat 系列 18 例,GSK 公司的 Ellipta 和 Diskus 系列 4 例,梯瓦公司的 HFA 和Respiclick/Digihaler 系列2例。这些产品线均跨多个类别:Respimat(LAMA、LABA、LAMA-LABA 和 SAMA-SAMA)、Ellipta(ICS、LAMA、LABA、LAMA-LABA 和 ICS-LAMA-LABA)、Diskus(ICS、LABA 和 ICS-LABA)和 Respiclick/Digihaler (ICS、ICS-LABA 和SABA)。
装置跳转
虽然药品制造商通过专利和独占权获得了对吸入制剂的长期保护,但他们通过 "装置跳转 "获得了对这些吸入制剂所含单个活性成分的更长时间的保护。这种策略是将相同的活性成分放入新的装置中,并获得新的专利和独占权,以确保更长的保护期。例如,我们的分析表明,葛兰素史克公司在其氟替卡松吸入制剂获得 FDA 批准后,通过连续发布含有氟替卡松的新吸入制剂装置,获得了长达35年的竞争保护:Flovent(1996 年批准)、Flovent Rotadisk(1997 年)、Flovent Diskus(2000 年)、Flovent HFA(2004 年),以及最近的 Arnuity Ellipta(2014 年)。
总体而言,制造商通过 15 种不同的原研吸入制剂实施了这一战略,并由此产生了 19 种不同的后续原研产品(见图 3)。三种原研吸入制剂 PrimateneMist、Ventolin 和 Proventil 是在研究期间之前获得批准的;所有其他原研吸入制剂和后续产品都是在研究期间获得批准的。在 19 种后续吸入制剂中,有 7 种(37%)是氢氟烷烃吸入制剂,取代了消耗臭氧的氯氟烷烃吸入制剂。在分析中剔除一种产品(Primatene Mist,其原研药于 1967 年获批,当时还没有桔皮书)后,制造商在原研药获批后到后续药的独占权或专利权最后到期前,获得的竞争保护期中位数为 28.1 年(IQR 21.3-33.5)。这一策略之所以能够奏效,是因为原研参比吸入制剂的仿制药仅针对特定的原研产品(即一种特定的药物-器械组合)获得批准。因此,当原研制造商发布新版吸入制剂(新药申请)时,旧产品的仿制药不能与新产品互换,也不能在药房自动替代该新产品。
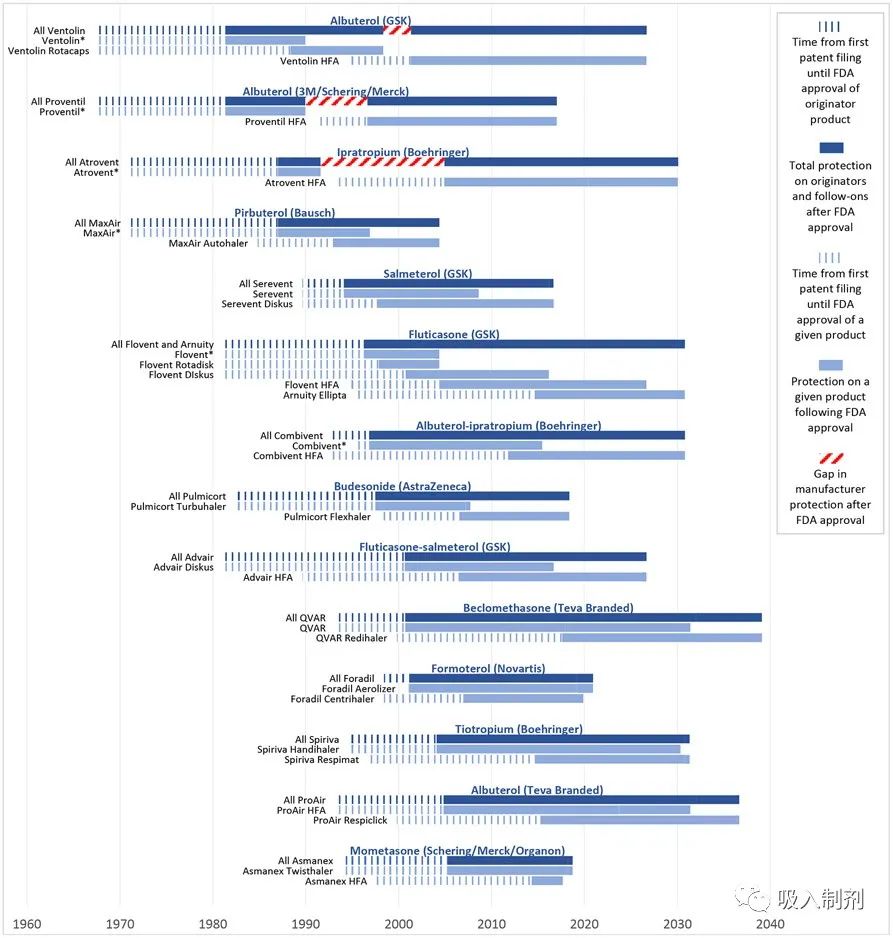
Exhibit 3: Device hops by inhaler manufacturers
Source: FDA Orange Book, Drugs@FDA, authors’ analysis
GSK: GlaxoSmithKline
*Denotes an inhaler containing chlorofluorocarbons (CFCs), which were removed from the market by the Food and Drug Administration beginning in the 2000s. This figure shows how manufacturers have preserved monopolies on inhaled medications by pairing old active ingredients with new devices. The notched dark blue bars represent the time that elapsed between the first patents filed for an originator product and FDA approval of that product. The solid dark blue bars represent the time that elapsed between FDA approval of an originator product and the last-to-expire exclusivity or patent on the originator or follow-on products. This reflects the total protection that a manufacturer has obtained on inhalers with a given active ingredient (or ingredients). The notched grey bars represent the time that elapsed between the first patents filings for a given product and FDA approval of that product. The solid grey bars represent the time that elapsed between FDA approval of a given product and the last-to-expire exclusivity or patent on that product. A median of 40.3 years (IQR 33.9-45.8) elapsed between the first patent filed on originator inhalers and the last-to-expire exclusivity or patent on these inhalers or their follow-ons. Manufacturers enjoyed a median of 28.1 years (IQR 21.3-33.5) of protection on these inhalers after FDA approval of the originator.
从专利申请到最后到期的专利或独占权到期的时间
制造商在获得FDA批准前15.1年(IQR 9.5-16.8)申请了吸入制剂的首批专利(附录A5)。从某一产品首次申请专利到该产品最后一项专利或独占权到期的时间中位数为29.2年(IQR 23.3-35.4)。ICS-LABA类吸入制剂的中位时间最长,为35.5年(IQR35.2-36.7),其次是LAMA类,为34.6年(IQR 32.7-35.4)。
在上一节分析的14个装置跳转案例中,从原研产品首次申请专利到原研产品或后续产品最后一项专利到期的中位时间为40.3年(IQR 33.9-45.8)(见图 3)。葛兰素史克公司于1967年为其沙丁胺醇吸入制剂(Ventolin)申请了专利,其后续产品沙丁胺醇吸入制剂的专利有效期至2026 年,即在首次申请专利 59 年后,产品之间的间隔仅为 3 年。葛兰素史克公司于 1981 年申请了首个氟替卡松吸入制剂(Flovent)专利,其后续氟替卡松吸入制剂的专利有效期到 2030 年,即从首次申请到现在的 49 年,产品之间没有间隔。在葛兰素史克公司的氟替卡松-沙美特罗吸入制剂和梯瓦原研公司的氯地米松吸入制剂上,我们也看到了类似的不间断专利串,专利期长达 46 年。
讨论
在过去的35年中,美国食品及药物管理局批准了62种治疗哮喘和慢性阻塞性肺病的吸入制剂,涉及10个治疗类别,但制造商提供的新药创新却寥寥无几。只有一种吸入制剂含有新作用机制的活性成分。制造商并没有开发新的治疗模式,而是改变了吸入式药物输送装置的设计,并试图通过监管独占权和专利来维护其市场份额,尤其是在这些装置上,在我们的队列中,吸入制剂制造商列出的所有专利中,有一半以上都是这些专利。制造商在不同类别的多种吸入制剂上重复使用相同的专利,并通过将旧的成分转移到新的装置上,在单个产品上行使市场权力。其结果是,许多受保护的原研吸入制剂含有首次获批于几十年前的活性成分,2022年初,美国市场上只有3种原研吸入制剂面临可互换仿制药的竞争(2 种原研沙丁胺醇吸入制剂和 1 种原研氟替卡松-沙美特罗吸入制剂)。尽管同类原研内的竞争可能有助于限制价格,但可互换的仿制药药竞争的匮乏限制了节约医疗支出。
我们的研究结果突显了美国现行监管体系是如何奖励对老产品进行增量调整的。使用氢氟烷烃(HFAs)作为推进剂的新型吸入制剂取代了含氯氟烷烃产品,并获得了专利和独占权的长期保护。也许最突出的例子就是Boehringer公司的Combivent(沙丁胺醇-异丙托溴铵)系列,从 1996年含氯氟烷烃版本获得批准到2030年非氯氟烷烃版本专利最后到期,该产品目前已拥有 34 年的专利保护期。如果不进行监管改革,随着制造商开发出更环保的吸入制剂来替代含氢氟烷烃的产品,这一过程很可能会重演,而氢氟烷烃产品本身就是温室气体的强效排放者。
尽管氯氟烷烃禁令可能有助于延长原研制造商获得的市场独占权,但在研究期间,吸入制剂的许多增量调整与禁令并无直接关系。约有三分之二的装置更换涉及到不同类型的吸入制剂(定量压力吸入气雾剂、干粉吸入制剂和软雾剂吸入制剂),而不是从含CFC的产品更换为含氢氟烷烃的产品。一些患者可能会从一种类型的吸入制剂装置中受益(基于吸气力量、灵巧性等因素),但治疗指南并不倾向于任何特定类型的吸入制剂装置,只要临床医生向患者提供有关正确技术的指导,并且患者能够自如地使用所选装置即可。
部分问题可能是临床医生的教育不足,也许装置类型的激增加剧了这一问题,但依从性差仍然是一个挑战。更重要的是,只要吸入制剂技术的改进能带来理想的获益,无论是与环境还是与患者的治疗效果有关,那么根本的问题仍然是,这些获益--在许多情况下即使有创造性,也只是微不足道的创造性--是否值得当前的监管体系给予数十亿美元的奖励。
2021年桔皮书透明法案要求FDA和政府问责办公室阐明并解决桔皮书中有争议的列名问题,包括药物与器械组合的专利问题。首先,可以禁止原研制造商在桔皮书中列出器械专利。在桔皮书中列出专利可以使制造商在潜在的仿制药制造商提出专利挑战时获得额外的独占权。此外,FDA还可以阻止制造商在获得批准后向桔皮书中添加专利,除非这些专利保护的是与真正的临床益处相关的改动。与此相关,FDA可以要求寻求在桔皮书中列出新版药物-器械组合专利的原研制造商(例如,含有活性成分的软雾吸入制剂已经以氢氟烷烃版本出售)在临床试验中证明新版本的优越性。
其次,除了桔皮书改革外,另一种削弱专利堆叠激励机制的建议方法是通过新的立法,允许制造商在批准仿制药药时只申请一项专利或独占权,以获得FDA的认可(这种方法被称为 "一步到位")。
最后,除了这种直接的监管改革外,美国专利商标局的改革也有助于提高已授权专利的质量。在这种模式下,美国专利商标局的一个由经验丰富的审查员组成的小组将对桔皮书中的专利进行审查,以检索现有技术,评估专利有效性,并对具有挑战性的案件进行审议。这种方法对于药物与装置的组合可能特别有价值,因为这种组合需要结合工程和制药方面的专业知识来进行适当的审查。
专利和监管独占权一直是拖延仿制药吸入制剂竞争的重要原因。然而,应该指出的是,这些并不是唯一的原因。FDA 对寻求批准仿制药的药物-器械组合的制造商提出了许多要求,这些要求超过了对简单口服药物的要求。FDA 正在想方设法简化药物-器械组合的审批程序,但这些产品的复杂性使其很难建立适当的互换性标准。
结论
在过去的35年中,吸入制剂制造商采取了各种策略,在原研吸入制剂上设立监管独占权和专利权,以限制仿制药的竞争。监管改革对于确保原研制造商的回报更好地反映新产品的额外临床效益至关重要。
(中国粉体网编辑整理/青黎)
注:图片非商业用途,存在侵权告知删除


















