中国粉体网讯 我们都知道活性药物(API)的粒径在固体制剂开发过程中至关重要,它会影响到制剂的关键质量属性含量均匀度和溶出曲线,还会影响到制备工艺。因此,我们在处方及工艺开发过程中应对API的粒径格外的重视。
然而,在处方开发的早期阶段,API的供应往往是不足的,但又需要必须选择一个合适范围的粒径。因此,有合适的模型用于粒径范围的预估就显得尤为重要。以下分别就含量均匀度、溶出曲线、工艺选择和制备工艺四个方面分别介绍粒径在其中所起的作用,及相关的预估模型,希望能对广大研发工作者在处方工艺开发早期阶段选择合适粒径范围API时提供帮助。
1.1 粒径对含量均匀度的影响
片剂或胶囊剂是由一定比例的API和辅料定量制备的,而具有不同粒径的API和辅料将具有不同的流动及装填性质,这就给混合物的分离(离析)带来风险,进而影响制剂的含量均一性。因此,在选择物料的粒径时,通常需要慎重考虑,以满足含量均一性的要求,尤其对于那些安全窗较窄的药物。辉瑞公司的BRIAN R. ROHRS 等人1开发了一个模型,用于预估满足USP<905>含量均匀度Content uniformity (CU) 要求时规格与粒径的函数关系。如下图1所示。
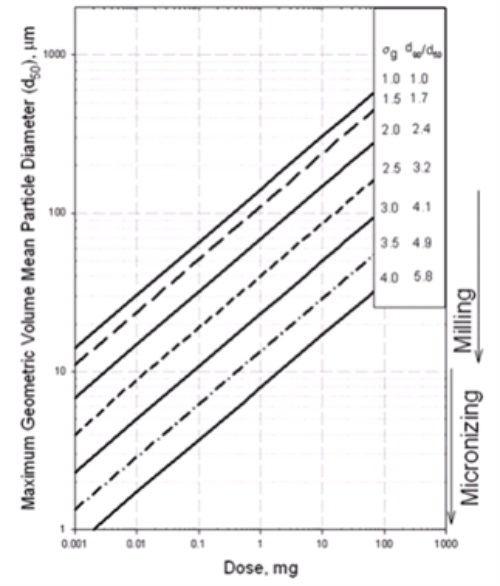
图1 规格与API粒径的函数关系
由图中可以得出,正态分布的情况下,规格越小,满足含量均匀度要求时,所需粒径也越小。粒径分布越窄(D90/D50越小),满足含量均匀度要求时,所需原料的粒径可以放得更宽(D50可以越大)。此模型提供了一个定量的粒径与规格的关系,作者使用粉末直压的工艺对该模型进行了验证。证明了模型的可用性。所以研究者可以根据此图大致的定量判断某一规格下,粒径(D50)最大不能超过的范围。
1.2 粒径对溶出的影响
药物分子要想发挥药效,首先需要在胃肠道溶解,然后才能被吸收进入体循环。对于难溶性药物,吸收的限速步骤通常是药物的溶出速率。由Noyes方程(如下图2)可知,溶出界面积S越小,溶出速率会越快。而溶出界面积S与颗粒的粒径相关,粒径越小,溶出界面积S会越大。因此,API粒径减小,溶出速率会变快。这类已被证实的例子有很多,如:硝苯地平、灰黄霉素、消炎痛和螺内酯等。

图2 Noyes方程
同样BRIAN R. ROHRS 等人3提出模型,漏槽条件下满足USP 30min溶出80%时,粒径与溶解度和粒径分布的函数。如图3所示,由图可知溶解度越高,所需的粒径可以放的越宽(粒径越大);粒径分布越窄,所需的粒径可以放的越宽;研究者可以根据此图大致定量的判断出满足溶出度要求时粒径所需达到的要求。当然,该模型有一定的前提,例如。粒径分布是对数正态分布的,而且处理多分散粒子的方法是基于每个粒子独立溶出这一假设,未考虑到粒子发生聚结、某个粒子受到其他粒子的影响等。因此,实际情况的溶出会更加复杂,该模型仅用于参考。
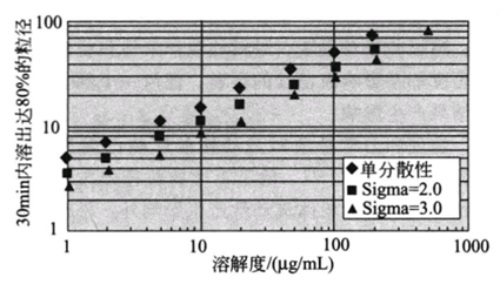
图3 漏槽条件下,满足USP 30min溶出80%条件,粒径与溶解度和粒径分布的函数
1.3 粒径对工艺选择的影响
有研究团队做了调查,人们在建立或选择稳健的工艺过程中,影响其抉择的API最重要的性质是粒径,排在第二位的才是API的形状4。由此可见,API粒径对制备工艺也至关重要。Michael Leane 等人5基于不同工艺路线提出生产分类系统(Manufacturing Classification System (MCS))时,把粒径作为API的一项基础理化性质,强调在工艺选择时需要重点关注。例如下图4,提出当选用直接压片工艺时,API的粒径D10一般要大于30μm,长宽比一般小于1.5,即API需要有足够好的流动性。如图5表明,当选用干法压片工艺时,API的粒径需要满足本文图1所示的ROHRS混合含量均匀度模型。
当然以上所说的粒径要求均是理想化的条件,即满足相应工艺对API粒径的要求时,工艺就会比较稳健,风险会比较低。超出所示的粒径要求时,也可以选用相应的工艺,但是风险会提高。
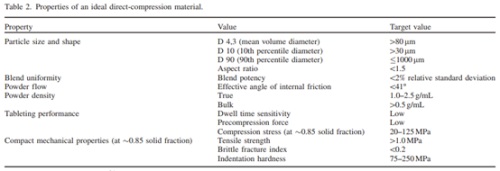
图4 直压工艺时理想的API性质
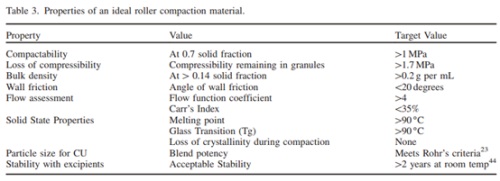
图5 干法制粒工艺时理想的API性质
1.4 粒径对制备工艺的影响
当API有不良的性质,不得不选用某种工艺时,研究粒径对某种特定工艺的影响就很有必要。例如当API对湿热敏感,往往就需要选用干法制粒或粉末直压工艺。此时,不同的粒径就会对工艺稳健性产生影响。例如图6所示,Leane M 等人4总结了GSK8个商业化处方,考察API粒径与辅料粒径的比值大小与渗透阈值之间的关系。(渗透阈值:压片时发生顶列或层压时的最大可耐受API量)。结果表明,粉末直压(DC)时API的平均粒径与辅料的平均粒径比值越大,API的渗透阈值会越大。分析原因是API的可压性一般比较差,当辅料粒径变小,但量占比不变的情况下,颗粒数目会变多,进而更容易组成片剂的骨架(辅料的可压性好与API)。当为干法制粒时(DG),API的平均粒径用制粒后颗粒的粒径代替,辅料粒径为外加辅料粒径时,依然符合粉末直压时得出的规律。以上提示我们,想把工艺做稳健、载药量提高,在API和辅料的粒径选择上需要更好的斟酌。
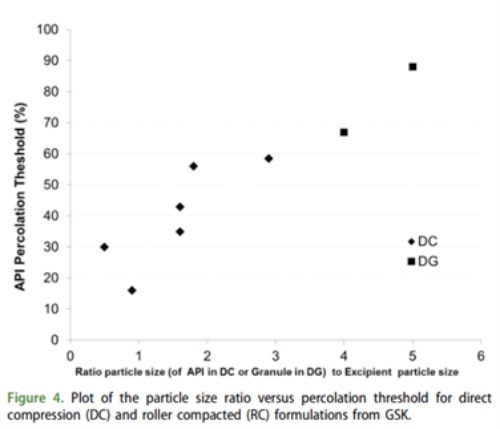
图6 API粒径与辅料粒径比值与API渗透阈值之间的函数
参考文献
1. Rohrs B R , Amidon G E , Meury R H , et al. Particle Size Limits to Meet USP Content Uniformity Criteria for Tablets and Capsules[J]. Journal of Pharmaceutical Sciences, 2006, 95(5):1049-1059.
2.Ende D J A , Rose P R . Strategies to Achieve Particle Size of Active Pharmaceutical Ingredients[M]. John Wiley & Sons, Ltd, 2006.
3.Rohrs B R , Amidon G E Particle Engineering:A Formulator’s Perspective. AAPS Arden House Conference. Harriman, New York
4.Leane M, Pitt K, Reynolds G K, et al. Manufacturing classification system in the real world: factors influencing manufacturing process choices for filed commercial oral solid dosage formulations, case studies from industry and considerations for continuous processing[J]. Pharmaceutical development and technology, 2018, 23(10): 964-977.
5. Leane M, Pitt K, Reynolds G, et al. A proposal for a drug product Manufacturing Classification System (MCS) for oral solid dosage forms[J]. Pharmaceutical development and technology, 2015, 20(1): 12-21.
(中国粉体网编辑整理/青黎)
注:图片非商业用途,存在侵权告知删除