中国粉体网讯 部分化疗药物(阿霉素、紫杉醇和奥沙利铂等)可通过引起肿瘤细胞免疫原性死亡(Immunogenic CellDeath,ICD),解除肿瘤微环境的免疫抑制,提高患者对免疫治疗的响应率,从而获得更好的治疗效果。然而,化疗药物在递送过程中仍面临释放过程不够可控和肿瘤免疫微环境调控性弱等挑战。因此,构建一种智能药物递送载体实现化疗药物的可控释放和免疫调控,对提高肿瘤的化疗-免疫综合治疗效果具有重要意义。
介孔二氧化硅(介孔硅)纳米材料具有合成简单、结构可控、化学剪裁性和生物相容性好等优点,具有较好的临床应用前景。如何围绕肿瘤微环境中微酸、乏氧、高氧化还原等特征,设计可响应肿瘤微环境内源特征发生降解和可控药物释放的智能介孔硅纳米载体,是该领域的前沿科学问题之一。
近期,中国科学院苏州生物医学工程技术研究所研究员董文飞课题组和华南理工大学研究员邵丹、大连理工大学教授孙文合作,构筑二硒键桥联介孔二氧化硅材料(MONs),通过配位和吸附作用担载含金属钌的小分子化疗药物(KP1339),并利用细胞膜包覆策略对载药纳米粒子进行功能化得到仿生纳米药物(CM@MON@KP1339)。一方面,通过材料中的硒和钌形成可控配位键,能够有效降低药物在运送过程中的意外释放;另一方面,材料可以响应肿瘤微环境中高水平谷胱甘肽(GSH)发生骨架降解,实现配位和还原双响应的药物可控释放。此外,该研究还发现,该材料具有调控肿瘤细胞的氧化还原平衡的生物活性,能够增强内质网应激,显著放大免疫原性死亡过程中相关因子的释放,进而增强肿瘤免疫原性。在此基础上,该仿生纳米药物通过联合免疫检查点阻断疗法,消除了乳腺癌原位肿瘤以及肺部转移灶,延长了小鼠的生存期,全程治疗未见明显的系统性毒性。
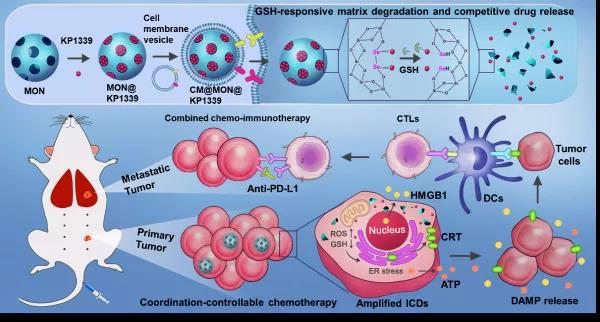
智能药物递送体系实现肿瘤化疗联合免疫治疗的示意图
上述工作为金属基小分子药物的可控递送提供了新材料,也为肿瘤的高效安全化疗联合免疫治疗提供了新思路。相关研究成果以CoordinationandRedox Dual-Responsive MesoporousOrganosilica Nanoparticles Amplify ImmunogenicCell Death forCancerChemoimmunotherapy为题,发表在Small上,并入选内封面论文。
(中国粉体网编辑整理/昧光)
注:图片非商业用途,存在侵权告知删除!