中国粉体网讯 开发高效低毒的新型放疗增敏剂,能够在较低的辐射剂量下实现肿瘤放疗,具有重大科学意义和应用前景。近日,深圳一研究团队通过整合金纳米棒的放射增敏特性和硒纳米颗粒的抗肿瘤活性,设计出核壳结构的金/硒纳米复合体系,并将表面修饰双靶向分子作为一种新型的纳米放疗增敏剂,实现肿瘤靶向的放化疗法。
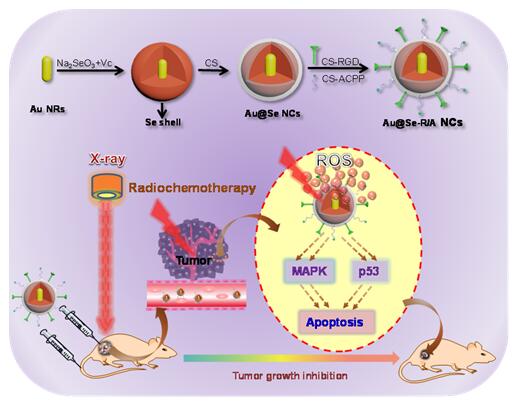
(金/硒核壳结构放增敏剂的设计思路和治疗作用示意图)
近日,中国科学院深圳先进技术研究院医药所研究员喻学锋和暨南大学化学与材料学院教授陈填烽合作,在肿瘤治疗纳米药物研究领域取得新进展。他们设计合成了一种金/硒核壳结构的靶向纳米复合体系,从而实现了肿瘤靶向的放化疗法。此项研究成果Designing Core–Shell Gold and Selenium Nanocomposites for Cancer Radiochemotherapy(《金/硒纳米复合物的设计与肿瘤放化疗应用》)发表在纳米期刊ACS Nano上。
恶性肿瘤是当前引起人类死亡的重要原因。X射线放疗是临床上常用的治疗癌症的方法,但其疗效受到射线辐射剂量的限制,导致肿瘤可能无法完全根除并可能导致肿瘤的复发和转移。放疗效果通常受限于一些乏氧肿瘤细胞的辐射抗性,而过量的辐射剂量可能会损害周围的健康组织并产生其他毒副作用。因此,开发高效低毒的新型放疗增敏剂,在较低的辐射剂量下实现肿瘤放疗,具有重大科学意义和应用前景。
近年来,大量的无机金属纳米粒子作为放疗增敏剂如雨后春笋般涌现。其放疗增敏的主要机制在于无机金属纳米粒子与X射线相互作用产生显著的光电效应以及康普顿效应,进而增强了X射线对肿瘤组织的损伤。其中,金纳米粒子因其独特的光学性质、良好的组织相容性、易控的表面修饰性等特点,使其在生物及医学领域有了广阔的应用前景。金纳米粒子因具有较高的原子序数(Z=79)和较大的光电吸收截面积,可以产生更强的辐射增强效果,成为近年来人们关注的焦点。另一方面,基于硒天然的抗肿瘤作用和良好的生物相容性,硒纳米颗粒可以作为一种有效的抗肿瘤药物载体。
研究团队通过整合金纳米棒的放射增敏特性和硒纳米颗粒的抗肿瘤活性,设计出核壳结构的金/硒纳米复合体系,并将表面修饰双靶向分子作为一种新型的纳米放疗增敏剂,实现肿瘤靶向的放化疗法。该纳米复合体系表现出优秀的肿瘤靶向能力、良好的生物安全、高效的放疗增敏作用和显著的抗肿瘤效果。机制研究表明:该纳米放疗增敏剂和X射线联合应用能够通过死亡受体途径诱导肿瘤细胞凋亡并促进ROS过量产生,从而激活下游ROS介导的信号通路,大大提高抗肿瘤活性。这项研究为肿瘤靶向放化疗提供了一种有效的临床可行的技术。